- TANTALE ET NIOBIUM
- TANTALE ET NIOBIUMLe tantale (symbole Ta) et le niobium (symbole Nb) sont deux métaux de transition du groupe Va de la classification périodique des éléments et, de ce fait, ont un grand nombre de points communs: ils sont presque toujours associés dans leurs minerais; leurs propriétés chimiques sont très voisines, ce qui rend particulièrement complexe leur séparation dans la phase d’extraction métallurgique; ils appartiennent tous deux à la classe des métaux appelés réfractaires (niobium, molybdène, tantale, tungstène).Le tantale fut découvert en 1802 par le Suédois Anders Gustaf Ekeberg qui lui donna ce nom mythologique à cause des très grandes difficultés rencontrées pour la dissolution de l’oxyde. Dans le même temps (1801), l’Anglais Charles Hatchett découvrait l’élément no 41 en analysant des roches en provenance d’Amérique du Nord (alors appelée Columbia) et lui attribua le nom de columbium. En 1844, l’Allemand Heinrich Rose, reprenant les études d’Ekeberg, isolait du tantale un nouvel élément qu’il appela niobium (du nom de Niobé, fille de Tantale). Mais l’on démontra rapidement que columbium et niobium n’étaient qu’un même élément. Ce n’est toutefois qu’en 1950 que l’Union chimique internationale officialisa le seul nom de niobium (mais, aux États-Unis, les métallurgistes emploient toujours le mot columbium).Dans la seconde moitié du XIXe siècle et au début du XXe, Jean Charles Gallissard de Marignac, Henri Moissan, Victor Moritz Goldschmidt, W. von Bolton et C. W. Balke mirent au point les premiers procédés de séparation et d’extraction de ces métaux. Leur production industrielle ne débuta toutefois qu’après 1946.La principale qualité du tantale est son exceptionnelle résistance à la corrosion dans un grand nombre de milieux chimiques agressifs, d’où de nombreuses applications en génie chimique. Plus récemment, les propriétés diélectriques de son oxyde lui ont ouvert un large débouché dans la production des condensateurs de haute performance.Le niobium et principalement les alliages à base de niobium présentent un ensemble de propriétés qui peuvent donner lieu à d’importantes applications dans des techniques de pointe, dont les principales sont l’électrotechnique (supraconductivité) et l’aérospatiale (résistance mécanique aux très hautes températures). Toutefois, l’industrie du niobium est encore dans sa phase de développement.1. MétallurgieMineraisLes deux métaux sont présents dans les minerais sous forme de pentoxydes (Ta25, Nb25) mélangés avec des oxydes d’autres métaux et non-métaux (fer, aluminium, silicium, manganèse principalement). Ces minerais contiennent de 30 à 85 p. 100 d’oxydes de Nb et de Ta, et les proportions relatives des deux oxydes varient de 10 à 90 p. 100. Les tantalites et les microlites sont les minerais les plus riches en tantale; les plus riches en niobium sont les pyrochlores et les colombites; les minerais contenant des proportions voisines de Ta et de Nb sont dénommés colombo-tantalites ou tantalo-colombites.Les principaux gisements se situent dans les pays suivants: Brésil (pyrochlores), Canada (tantalites), Nigeria, Zaïre, Afrique du Sud, Australie, Portugal. Le tantale et le niobium sont souvent présents aussi dans les minerais d’étain. Les scories d’exploitation des mines d’étain (Malaisie, Thaïlande et accessoirement Zaïre) constituent un minerai pauvre (de 12 à 20 p. 100 de Ta25 + Nb25, dont 10 à 15 p. 100 de Ta25), mais disponible en quantités très abondantes, dépendant toutefois de l’activité de production de l’étain. À l’heure actuelle, elles sont pratiquement les seules sources industrielles de production du tantale.Les réserves mondiales de tantale sont estimées actuellement à 500 000 t de métal; celles de niobium, beaucoup plus abondantes, à 10 millions de tonnes.Procédés d’extractionAprès épuration du minerai, concentration et attaques chimiques, on obtient un mélange des oxydes Ta25 + Nb25 déjà assez pur. Il s’agit ensuite de séparer Nb et Ta, opération difficile du fait des propriétés chimiques très voisines de ces métaux et de leurs composés. Cette séparation doit être très poussée, car le niobium s’avère une impureté néfaste pour la résistance à la corrosion du tantale, tandis que le tantale est une impureté gênante pour une utilisation nucléaire du niobium, sa section de capture étant très élevée.Industriellement, on opère la séparation par un procédé dit «liquide-liquide»: les oxydes sont transformés en fluoacides en solution aqueuse, envoyés soit en colonnes verticales, soit en bacs horizontaux, à contre-courant d’un solvant organique spécifique du tantale (méthylisobutylcétone). Le composé du tantale est entraîné par le solvant organique, celui du niobium restant dans la phase aqueuse. De chacune des phases traitées séparément, on peut précipiter soit un fluorure double, soit l’hydrate que l’on calcine ensuite à l’air pour obtenir le pentoxyde pur.L’industrie extrait le tantale suivant trois procédés:– par électrolyse en bain de sel fondu:
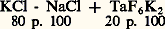 qu’on alimente en Ta25; les dendrites de tantale se déposent dans le creuset en fer servant de cathode;– par carbothermie; l’oxyde mélangé au carbone est chauffé à 2 300 0C sous vide poussé; le carbone réduit alors l’oxyde suivant la réaction théorique:
qu’on alimente en Ta25; les dendrites de tantale se déposent dans le creuset en fer servant de cathode;– par carbothermie; l’oxyde mélangé au carbone est chauffé à 2 300 0C sous vide poussé; le carbone réduit alors l’oxyde suivant la réaction théorique: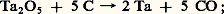 en fait, on opère en général en deux stades dont le premier conduit à l’obtention du carbure de tantale;– par réduction de Ta6K2 par le sodium ; le mélange de ces deux matériaux est chauffé vers 1 000 0C en creuset d’acier et l’on obtient un mélange des fluorures alcalins et de tantale métallique sous forme relativement divisée, que l’on extrait par une série de lavages chimiques.L’extraction du niobium s’effectue suivant les mêmes méthodes, sauf cependant l’électrolyse qui n’est pas praticable, le niobium déposé à la cathode étant partiellement réoxydé. Grâce aux minerais de niobium relativement riches et purs disponibles (pyrochlore), on peut mettre en œuvre des méthodes particulières à partir de concentrés de pyrochlores: aluminothermie, permettant la production massive directe d’un métal contenant quelques pour cent d’aluminium et d’oxygène, que l’on épure ultérieurement en plusieurs fusions par bombardement électronique; chloruration, épuration du chlorure par distillation fractionnée, puis réduction du chlorure par l’hydrogène ou oxydation du chlorure et extraction du métal par une des méthodes décrites précédemment (carbothermie ou métallothermie). Suivant que l’on pousse plus ou moins loin la distillation fractionnée, on obtient un niobium dont la pureté varie de 99,8 p. 100 à 99,9 p. 100.Ces différentes méthodes d’extraction conduisent à un métal brut sous forme de dendrites, granules, éponge ou poudre. Ces produits peuvent être utilisés tels quels ou, si nécessaire, transformés en poudre: par chauffage sous hydrogène vers 600 à 800 0C le métal passe sous forme d’hydrure, produit très fragile, facilement broyable en poudre de la finesse désirée; un chauffage sous vide vers 900 et 1 000 0C provoque la déshydruration totale. Ce procédé d’hydruration-déshydruration sert soit à produire des poudres spéciales pour réaliser des condensateurs en partant de lingots de métal pur fondus par bombardement électronique, soit à récupérer des déchets massifs.TransformationConsolidationPour passer des granules ou de la poudre à une forme massive utilisable, il existe trois procédés de consolidation.– Le frittage : le métal, sous forme de poudre fine, est comprimé à froid en barreaux parallélépipédiques (de 3 à 50 kg). Chaque barreau est placé dans un four et chauffé par effet Joule sous un vide d’au moins 10-3 pascal. La puissance de chauffage augmentant progressivement, les impuretés gazeuses (H, N, C + O, O) se dégagent, certaines impuretés métalliques s’évaporent, et l’on atteint la température maximale de 2 600 0C (cas du tantale) ou 2 200 0C (cas du niobium), qui est maintenue de quatre à huit heures. Ce premier frittage doit être suivi d’un léger travail à froid puis d’un deuxième frittage. Les limitations du procédé sont le faible poids unitaire des barreaux obtenus, une épuration parfois insuffisante et son coût élevé. On ne l’applique donc plus que dans quelques cas particuliers.– La fusion à l’arc en électrode consommable sous vide : la difficulté de ce procédé est due à la géométrie même du four, qui entraîne une très mauvaise épuration du métal. Il faut donc, pour que l’épuration soit assurée, alimenter le four en électrodes préalablement frittées (elle serait insuffisante à partir de granules bruts simplement comprimés). Le cycle est coûteux.– La fusion par bombardement électronique : c’est la méthode de choix, car elle permet une très bonne épuration du métal. Des lingots qui peuvent atteindre un diamètre de 400 mm (en niobium) ou un poids de 500 kg (en tantale) sont produits industriellement. Après une telle opération, les teneurs en impuretés sont relativement basses (tabl. 1), ce qui est nécessaire pour permettre de transformer le métal dans de bonnes conditions et obtenir un comportement optimal dans certaines applications (résistance à la corrosion, supraconductivité, etc.).Transformation en demi-produitsLa transformation en demi-produits est relativement aisée si le matériau a été convenablement épuré. Elle s’opère à la température ordinaire par les moyens classiques de forgeage, laminage, étirage, tréfilage, emboutissage; le métal peut subir des degrés d’écrouissage à froid considérables et d’autant plus élevés qu’il est plus pur. Lorsqu’il devient trop résistant à la déformation, on lui fait subir des traitements intermédiaires ou finals, soit d’adoucissement (de 700 à 900 0C), soit de recristallisation (de 1 050 à 1 200 0C), qui s’opèrent obligatoirement sous un vide d’au moins 10-3 pascal, tout chauffage dans l’air ou dans un gaz quelconque sauf l’argon ou l’hélium très pur, même à 100 0C, étant absolument néfaste pour la ductilité du métal.Toutefois, les alliages à base de niobium ou de tantale conçus pour présenter de hautes caractéristiques mécaniques aux températures élevées doivent être transformés à haute température (de 1 000 à 1 500 0C) dans les phases de dégrossissage, les opérations de finition s’effectuant pour les plus résistants soit à froid, soit à tiède (de 400 à 800 0C).Mise en œuvreLes opérations classiques de travail à froid (pliage, emboutissage, repoussage, martelage, etc.) ne présentent pas de difficultés sur le tantale ou le niobium non alliés. Les deux métaux s’usinent bien. On doit cependant tenir compte, si l’on envisage la rectification, d’une forte tendance à adhérer aux outils. Compte tenu de leur très grande réactivité avec l’air dès 100 0C, deux opérations sur eux doivent être conduites avec des soins particuliers:– le soudage, qui doit nécessairement s’effectuer sous argon ou hélium purifié (soudage par point ou à l’arc), ou mieux sous vide (soudage par bombardement électronique); une soudure exécutée dans des conditions correctes possède les mêmes propriétés (plasticité, résistance à la corrosion) que celles du métal de base;– les recuits adoucissants doivent être pratiqués exclusivement sous vide de 10-2 ou de préférence 10-3 à 10-4 pascal, sur des produits dégraissés et décapés.2. PropriétésPropriétés physiquesLe tantale a pour numéro atomique 73 et pour poids atomique 180,95. Ses propriétés physiques marquantes sont portées dans le tableau 2. Le cristal est cubique centré, de paramètre a = 3,296; il n’y a aucune transformation allotropique. Il faut enfin signaler une propriété extrêmement importante: la valeur très élevée (de l’ordre de 25 à 28) de la constante diélectrique de l’oxyde de tantale.Le niobium a pour numéro atomique 41. Son poids atomique est de 92,91. Le tableau 2 rassemble ses principales propriétés physiques. Le cristal est cubique centré à toutes températures (pas de transformation allotropique). La section de capture des neutrons thermiques est faible: 1,1 barn/atome, à comparer, d’une part, avec celle du béryllium (0,009), du magnésium (0,06), du zirconium (0,18), de l’aluminium (0,23) et, d’autre part, du fer et des aciers (2 à 3), du tantale (22).Du point de vue de la résistivité électrique, la température de transition en dessous de laquelle le métal devient supraconducteur (c’est-à-dire prend une résistivité nulle) est de 9,2 K (température la plus élevée des métaux purs), avec, toutefois, un champ critique relativement faible (0,25 T), ce qui est le cas de tous les métaux purs.Enfin, comme l’oxyde de tantale, l’oxyde de niobium a une constante diélectrique élevée (de l’ordre de 20 à 25).Propriétés chimiquesLes deux métaux ont un comportement très voisin avec deux traits dominants: une grande réactivité vis-à-vis des gaz à partir d’une température modestement élevée et une passivité exceptionnelle dans un grand nombre de milieux chimiques agressifs.Réaction avec les gazDans l’air sec ou humide et à température ambiante, les deux métaux restent parfaitement inertes. Dès que la température s’élève, et ce à partir de 200 à 300 0C, on constate une attaque se développant de deux façons: contamination par diffusion de l’oxygène vers l’intérieur; formation d’une couche d’oxyde fragile et à forte augmentation de volume. Cette couche d’oxyde se forme au-dessus du métal et le consomme plus ou moins rapidement. La figure 1 montre, de ce point de vue, les positions relatives du tantale et du niobium par rapport à d’autres métaux.L’hydrogène diffuse et se solubilise dans les deux métaux à partir de 100 0C. La vitesse de réaction croît avec la température, devient notable dès 300 0C et très rapide entre 600 et 800 0C, transformant tout le métal en hydrure extrêmement fragile. L’hydrogène est facilement éliminé par traitement entre 800 et 1 200 0C sous vide. Cette fragilisation par l’hydrogène est un risque grave latent dans la fabrication et l’utilisation. Tout particulièrement pour les emplois en milieux corrosifs, on évitera très soigneusement de provoquer une formation d’hydrogène naissant au voisinage du tantale et du niobium et, par exemple, les contacts avec le graphite ou des métaux tels que le fer, l’aluminium, le zinc par rapport auxquels le tantale ou le niobium sont cathodiques.La plupart des autres gaz (ammoniac, gaz de combustion, CO, CO2) réagissent avec les deux métaux à plus ou moins haute température.Jusqu’à 200 0C, l’eau et la vapeur d’eau n’ont aucune action, ni corrosive ni fragilisante, à condition bien sûr que tout autre gaz soit éliminé et aussi que le pH soit maintenu inférieur à 8. Au-delà de 200 0C, on constate une détérioration progressive de la tenue par suite d’une fragilisation par l’hydrogène.Réaction avec les milieux chimiquesEn résumé, on peut dire que le tantale résiste parfaitement, jusqu’à des températures de 180 à 200 0C, à tous les milieux acides ou neutres, aussi complexes qu’on puisse les imaginer, avec les exceptions suivantes: présence d’acide fluorhydrique, ou de fluor ou d’ions - libres; présence de S3 libre.En revanche, les bases fortes, même à faible concentration, attaquent et fragilisent le tantale à chaud.Vis-à-vis de nombreux acides, le tantale présente donc une inertie très voisine de celle du verre (sans en avoir la fragilité) et résiste même beaucoup mieux que lui aux solutions chaudes d’acide chlorhydrique.La figure 2 donne les tenues comparées du tantale et de quelques autres métaux dans l’acide chlorhydrique chaud et dans l’acide sulfurique bouillant. Cette immunité remarquable du tantale est due à la présence d’une couche superficielle d’oxyde Ta25 extrêmement tenace.On constate de très grandes similitudes du niobium avec le tantale, en particulier pour l’essentiel des phénomènes qui expliquent la remarquable résistance à la corrosion; mais la tenue de la couche passivée est moins bonne et la sensibilité à l’hydrogène plus grande.À 100 0C, la liste des milieux vis-à-vis desquels le niobium reste absolument inerte est relativement limitée: acide nitrique à toute concentration, acide chlorhydrique dilué, acide sulfurique à 20 p. 100, acide tartrique.En résumé, le niobium est un métal extrêmement résistant à la corrosion si on le compare au titane, aux aciers inoxydables, etc.; mais dans l’ensemble des cas cette résistance est presque toujours inférieure et au mieux égale à celle du tantale.Réaction avec les métaux fondusLa tenue du niobium et du tantale est généralement bonne en comparaison de celle d’autres métaux. Il n’y a pratiquement aucune attaque par le bismuth (jusqu’à 560 0C), le gallium (jusqu’à 400 0C), le plomb (jusqu’à 850 0C), le lithium (jusqu’à 1 000 0C), le mercure (jusqu’à 600 0C), le sodium, le potassium et leurs mélanges (jusqu’à 1 000 0C), l’étain (jusqu’à 700 0C), le zinc (jusqu’à 450 0C).Propriétés mécaniquesTant pour le tantale que pour le niobium, les propriétés mécaniques sont très sensibles à la pureté du métal et tout particulièrement aux teneurs en éléments interstitiels (oxygène, azote, carbone, hydrogène) qui provoquent un durcissement et une fragilisation. Pour un métal utilisable industriellement, il est souhaitable que le niveau de toutes ces impuretés reste inférieur à 100 ppm. C’est le cas du tantale et du niobium dits de pureté commerciale.Dans ces conditions de pureté et à l’état recuit, les deux métaux se caractérisent, à température ordinaire, par une dureté Vickers de 60 à 80 et une résistance à la rupture en traction de 30 à 45 hbar, avec les allongements correspondants de 25 à 40 p. 100.Comme pour tous les métaux, on observe une chute brutale de la ductilité en deçà d’une certaine température, dite température de transition ductile-fragile; elle est de l’ordre de 漣 150 0C pour le niobium et de 漣 270 0C pour le tantale (alors qu’elle est très nettement supérieure à 20 0C dans le cas de métaux tels que le tungstène ou le molybdène).3. Alliages à base de tantale ou de niobiumLes alliages élaborés à base de tantale ou de niobium ont pour but d’améliorer les propriétés de ces métaux principalement dans trois domaines: la supraconductibilité (niobium seulement); la tenue à la corrosion chimique; la tenue mécanique aux hautes températures (et corrélativement la résistance à l’oxydation).Les alliages supraconducteursUn matériau devient supraconducteur (c’est-à-dire possède une résistivité électrique nulle) lorsqu’il est maintenu à une température inférieure à une certaine valeur Tc (dite température critique), soumis à un champ magnétique inférieur à une certaine valeur Hc (dite champ critique) et parcouru par un courant d’une intensité inférieure à une certaine valeur (dite intensité critique Ic ). Chacune de ces valeurs critiques est en outre fonction des deux autres. Le but des alliages est d’obtenir des Tc , Hc , Ic de plus en plus élevées et des relations f – par exemple Hc = f (Ic ) – les plus favorables possibles. Le tableau 3 présente les valeurs de Tc et Hc (à 4,2 K) obtenues pour le niobium et certains de ses alliages.Les valeurs de Tc , Ic , Hc et les relations qui les lient dépendent non seulement de la composition de l’alliage, mais aussi, et très fortement, de sa teneur en impuretés, de son état structural (l’écrouissage et autres défauts de structure favorisant la supraconductivité), de son traitement thermique.Historiquement, ce sont les alliages Nb-Zr qui furent les premiers fabriqués industriellement, mais ils ont été totalement supplantés par les Nb-Ti, qui non seulement ont de meilleures propriétés globales, mais sont aussi beaucoup plus ductiles (même très ductiles). Les propriétés du Nb3Sn sont jusqu’ici inégalées; malheureusement, il s’agit là d’un composé intermétallique extrêmement fragile dont la mise en forme en tant que tel est quasi impossible. Pour le mettre en œuvre, il faut donc recourir à des procédés très spéciaux, ce qui freine son développement.Les alliages résistant à la corrosion chimiqueDans le cas du tantale, les additions se sont en général révélées néfastes pour la tenue à la corrosion. Seules les additions du tungstène (de 10 à 30 p. 100) améliorent légèrement son comportement, surtout en milieux fluorés. L’addition de titane (de 5 à 20 p. 100) augmente la tenue dans l’acide nitrique concentré à chaud.En pratique, on en reste donc au tantale non allié, avec toutefois une tendance croissante à l’emploi de tantale contenant entre 1 et 3 p. 100 de tungstène qui est semblable au tantale non allié du point de vue résistance à la corrosion, mais qui présente une meilleure résistance mécanique sans perte trop grave de ductilité.Dans le cas du niobium, on a mis au point, pour résister à la vapeur d’eau, des alliages avec additions de Ti, V, Cr. Dans les métaux fondus, l’alliage Nb + 1 p. 100 Zr résiste plutôt mieux que le niobium non allié. Certaines additions (tantale, vanadium, cuivre) améliorent la tenue du niobium dans les milieux très agressifs.Alliages réfractaires pour hautes températuresPartant des propriétés mécaniques favorables du niobum à haute température, on peut considérer que ce métal est une base intéressante puisqu’il a une faible densité (par rapport aux autres métaux réfractaires, tungstène, tantale, molybdène), une résistance à l’oxydation moins mauvaise que celle du molybdène et une ductilité à froid supérieure.Pour améliorer la tenue à chaud, on durcit la matrice niobium soit en introduisant des durcisseurs rentrant en solution solide (le tungstène et le molybdène sont, de ce point de vue, les éléments les plus efficaces), soit en utilisant des dispersions stables: la présence dans la matrice de zirconium ou d’hafnium d’une part, de carbone, d’oxygène, d’azote ou de bore d’autre part conduit à la formation de composés. La taille et la dispersion de ces phases hors solution peuvent être contrôlées par des traitements thermiques convenables. Ces dispersions bloquent efficacement le mouvement des dislocations et, par conséquent, gênent la déformation de fluage à chaud.L’une des difficultés vient de l’effet plus ou moins marqué de toutes ces additions sur la ductilité.D’autre part, puisqu’il s’agit d’alliages devant résister à chaud, on a cherché à améliorer la résistance à l’oxydation, relativement mauvaise, du niobium. Malheureusement, les additions qui ont quelque effet de ce point de vue (Ti, Al, Si, Cr) ont soit une influence néfaste sur la tenue au fluage, soit fragilisent le plus souvent l’alliage de façon inacceptable.Comme il n’a pas été possible jusqu’à présent de concilier les deux nécessités, on s’est axé uniquement sur l’aspect résistance mécanique en laissant le soin à des revêtements protecteurs de pallier le manque de résistance à l’oxydation. Mais le problème du revêtement protecteur correct est encore très imparfaitement résolu.La figure 3 situe les alliages de niobium par rapport à d’autres alliages résistants à chaud (sur la base de la résistance spécifique, car les applications majeures de ces alliages se situent dans les industries aérospatiales).Dans le cas du tantale, les recherches d’alliages résistants à chaud ont été moins poussées. A priori, la très haute température de fusion du tantale permet de penser que les alliages à base de tantale seront beaucoup plus réfractaires que ceux du niobium. Mais la densité du tantale constitue un lourd handicap dans les applications aérospatiales, qui sont les seules tentantes pour l’instant. Avec des additions de tungstène, de hafnium, de vanadium, les caractéristiques qu’on obtient entre 1 200 et 1 500 0C sont intéressantes.4. ApplicationsÉnergie nucléaireLe niobium et certains de ses alliages (par exemple Nb + 1 p. 100 Zr) peuvent être utilisés comme des matériaux de gainage et comme conduites de fluides caloporteurs des réacteurs nucléaires avancés fonctionnant à haute température. Les avantages du niobium sont ici la faible section de capture, la compatibilité avec la plupart des combustibles et fluides caloporteurs et la résistance mécanique à chaud intéressante.Génie chimiqueLes applications du tantale sont ici très nombreuses. C’est principalement dans les milieux acides chauds, et tout particulièrement en milieu sulfurique, qu’il est employé, soit sous forme de revêtement chaudronné placé dans des capacités en acier, soit sous forme de tubes constituant des échangeurs de chaleur. Le tantale apparaît comme un métal tout à fait indispensable dans le génie chimique moderne. Citons encore les implants dentaires, les fils et plaques utilisés en chirurgie, le tantale restant inerte dans le corps humain.ÉlectroniqueL’application aujourd’hui la plus importante du tantale, si l’on considère les quantités consommées, se rencontre dans la fabrication des condensateurs soit sous forme de feuille mince, soit surtout sous forme d’anode frittée. Les condensateurs qu’on réalise ont une très forte capacité et des caractéristiques très stables dans un large domaine de température (de 漣 70 à + 200 0C).Le condensateur à feuille de tantale a, pour un même volume, une capacité sept fois plus forte que le condensateur papier. Les performances des condensateurs à anode poreuse, schématisés sur la figure 4, sont encore plus remarquables.La pièce principale est l’anode, obtenue par frittage de poudre de tantale à température relativement basse (de 1 800 à 2 000 0C), ce qui laisse une grande porosité ouverte (de 30 à 50 p. 100). L’anode est ensuite oxydée anodiquement. La porosité de l’anode donne une surface active très élevée, et la capacité par unité de volume est mille fois supérieure à celle du condensateur papier. L’utilisation de tels condensateurs en électronique permet de miniaturiser davantage les circuits; elle se répand dans tous les domaines, y compris celui de la consommation courante.SupraconductivitéCe domaine est dominé par le niobium et ses alliages, alors que le tantale en est quasiment exclu.L’utilisation du niobium ou de ses alliages dans leur état supraconducteur ouvre des horizons immenses à toute l’électrotechnique (générateurs, moteurs, bobinages magnétiques, lignes de transport), car on pourrait ainsi produire, absorber ou transporter des puissances énormes sous de très faibles volumes et pratiquement sans perte. Toutefois, de très gros problèmes restent encore à surmonter. C’est pourquoi il n’y a pour l’instant que quelques très rares réalisations de laboratoire dans le domaine du moteur, du générateur ou du conducteur de puissance.En revanche, un développement important se rencontre dans un domaine relativement plus facile, celui des bobines électromagnétiques dont a besoin la physique avancée pour disposer de champs magnétiques extrêmement intenses, irréalisables par d’autres moyens. Les conducteurs utilisés sont du type de ceux dont une section est reproduite sur la figure 5.Utilisations à haute températureLa réalisation de résistors et d’écrans de fours à vide à très haute température constitue une application relativement banale du tantale. Par rapport à ses concurrents (molybdène et tungstène) dans ce domaine, le tantale présente l’avantage d’une mise en forme très facile et de ne pas se fragiliser trop rapidement en service.Pour les alliages de niobium, deux types d’applications beaucoup plus avancées sont étudiés:– dans les moteurs à réaction, d’une part, où le remplacement des alliages superréfractaires par des alliages de niobium dans la partie turbine permettrait de fonctionner à une température plus élevée de 150 0C, donc d’obtenir un gain de puissance substantiel; mais les alliages de niobium en question n’ont pas une bonne résistance à l’oxydation, et il faut les munir de revêtements protecteurs; les progrès dans ce dernier domaine n’ont pas été aussi rapides que dans celui de la métallurgie, et si les meilleurs revêtements connus protègent très efficacement à l’origine, ils se dégradent toutefois assez rapidement et ont donc une durée de vie limitée et encore insuffisante;– dans les véhicules spatiaux d’autre part, pour réaliser les parties de structure qui subissent des échauffements très élevés au moment de la rentrée dans l’atmosphère terrestre.Le tantale est utilisé en tant qu’addition (en teneur de 4 à 10 p. 100) dans des alliages superréfractaires à base de nickel ou de cobalt.Enfin, on ajoute du carbure de tantale au carbure de tungstène pour réaliser des carbures frittés pour outils de coupe de haute performance.Le niobium s’avère être un élément d’addition de plus en plus largement utilisé en aciérie, pratiquement dans toutes les qualités d’aciers ou de superalliages. Il a pour effet, suivant les types d’aciers, de permettre une répartition fine et stable des carbures, ou d’affiner et de stabiliser le grain, ou de réduire notablement les phénomènes de corrosion intergranulaire. Le niobium n’est pas introduit dans ce cas sous forme métallique mais sous forme d’alliages mères, ferro-niobium ou ferro-niobium-tantale, obtenus directement par aluminothermie à partir des minerais riches concentrés.Production et consommationLa production totale de tantale métallique dans le monde capitaliste a été de 750 t en 1970 et de 1 000 t environ en 1982. La consommation de ce métal en 1970 s’est répartie comme suit: 65 p. 100 pour la fabrication de condensateurs (il faut à ce sujet noter que si, dans les dix dernières années, la production annuelle de condensateurs au tantale a été multipliée par un facteur proche de 1 000, la consommation correspondante a cependant beaucoup moins progressée du fait des améliorations considérables obtenues dans les propriétés ad hoc des poudres de tantale), 20 p. 100 pour la production de demi-produits destinés aux appareillages de génie chimique, 10 p. 100 pour la production de carbure de tantale et 5 p. 100 pour addition dans les alliages super-réfractaires. Plus de 75 p. 100 du tantale produit est consommé aux États-Unis.En niobium contenu, la production totale du monde capitaliste a été de 7 000 t en 1970 et de 10 000 t par an à partir de 1978 jusqu’en 1982. Mais la quasi-totalité a été utilisée en tant que ferro-niobium, donc sans passer par le stade de l’extraction du niobium métallique. Dans cette production, les États-Unis interviennent pour 20 p. 100, la république fédérale d’Allemagne pour 16 p. 100, la France, la Grande-Bretagne, le Canada, le Japon pour 12 p. 100 chacun, l’Autriche et la Suède pour 7 p. 100 chacune. Entre 1982 et 1990, il n’y a guère eu de modifications.La production de niobium métallique oscille entre 15 et 60 t par an, dont 90 p. 100 aus États-Unis, qui interviennent également pour 90 p. 100 dans la consommation mondiale, pour les applications suivantes: alliages supraconducteurs, 70 p. 100; alliages résistants à chaud, 15 p. 100; énergie nucléaire, 10 p. 100; divers, 5 p. 100.
en fait, on opère en général en deux stades dont le premier conduit à l’obtention du carbure de tantale;– par réduction de Ta6K2 par le sodium ; le mélange de ces deux matériaux est chauffé vers 1 000 0C en creuset d’acier et l’on obtient un mélange des fluorures alcalins et de tantale métallique sous forme relativement divisée, que l’on extrait par une série de lavages chimiques.L’extraction du niobium s’effectue suivant les mêmes méthodes, sauf cependant l’électrolyse qui n’est pas praticable, le niobium déposé à la cathode étant partiellement réoxydé. Grâce aux minerais de niobium relativement riches et purs disponibles (pyrochlore), on peut mettre en œuvre des méthodes particulières à partir de concentrés de pyrochlores: aluminothermie, permettant la production massive directe d’un métal contenant quelques pour cent d’aluminium et d’oxygène, que l’on épure ultérieurement en plusieurs fusions par bombardement électronique; chloruration, épuration du chlorure par distillation fractionnée, puis réduction du chlorure par l’hydrogène ou oxydation du chlorure et extraction du métal par une des méthodes décrites précédemment (carbothermie ou métallothermie). Suivant que l’on pousse plus ou moins loin la distillation fractionnée, on obtient un niobium dont la pureté varie de 99,8 p. 100 à 99,9 p. 100.Ces différentes méthodes d’extraction conduisent à un métal brut sous forme de dendrites, granules, éponge ou poudre. Ces produits peuvent être utilisés tels quels ou, si nécessaire, transformés en poudre: par chauffage sous hydrogène vers 600 à 800 0C le métal passe sous forme d’hydrure, produit très fragile, facilement broyable en poudre de la finesse désirée; un chauffage sous vide vers 900 et 1 000 0C provoque la déshydruration totale. Ce procédé d’hydruration-déshydruration sert soit à produire des poudres spéciales pour réaliser des condensateurs en partant de lingots de métal pur fondus par bombardement électronique, soit à récupérer des déchets massifs.TransformationConsolidationPour passer des granules ou de la poudre à une forme massive utilisable, il existe trois procédés de consolidation.– Le frittage : le métal, sous forme de poudre fine, est comprimé à froid en barreaux parallélépipédiques (de 3 à 50 kg). Chaque barreau est placé dans un four et chauffé par effet Joule sous un vide d’au moins 10-3 pascal. La puissance de chauffage augmentant progressivement, les impuretés gazeuses (H, N, C + O, O) se dégagent, certaines impuretés métalliques s’évaporent, et l’on atteint la température maximale de 2 600 0C (cas du tantale) ou 2 200 0C (cas du niobium), qui est maintenue de quatre à huit heures. Ce premier frittage doit être suivi d’un léger travail à froid puis d’un deuxième frittage. Les limitations du procédé sont le faible poids unitaire des barreaux obtenus, une épuration parfois insuffisante et son coût élevé. On ne l’applique donc plus que dans quelques cas particuliers.– La fusion à l’arc en électrode consommable sous vide : la difficulté de ce procédé est due à la géométrie même du four, qui entraîne une très mauvaise épuration du métal. Il faut donc, pour que l’épuration soit assurée, alimenter le four en électrodes préalablement frittées (elle serait insuffisante à partir de granules bruts simplement comprimés). Le cycle est coûteux.– La fusion par bombardement électronique : c’est la méthode de choix, car elle permet une très bonne épuration du métal. Des lingots qui peuvent atteindre un diamètre de 400 mm (en niobium) ou un poids de 500 kg (en tantale) sont produits industriellement. Après une telle opération, les teneurs en impuretés sont relativement basses (tabl. 1), ce qui est nécessaire pour permettre de transformer le métal dans de bonnes conditions et obtenir un comportement optimal dans certaines applications (résistance à la corrosion, supraconductivité, etc.).Transformation en demi-produitsLa transformation en demi-produits est relativement aisée si le matériau a été convenablement épuré. Elle s’opère à la température ordinaire par les moyens classiques de forgeage, laminage, étirage, tréfilage, emboutissage; le métal peut subir des degrés d’écrouissage à froid considérables et d’autant plus élevés qu’il est plus pur. Lorsqu’il devient trop résistant à la déformation, on lui fait subir des traitements intermédiaires ou finals, soit d’adoucissement (de 700 à 900 0C), soit de recristallisation (de 1 050 à 1 200 0C), qui s’opèrent obligatoirement sous un vide d’au moins 10-3 pascal, tout chauffage dans l’air ou dans un gaz quelconque sauf l’argon ou l’hélium très pur, même à 100 0C, étant absolument néfaste pour la ductilité du métal.Toutefois, les alliages à base de niobium ou de tantale conçus pour présenter de hautes caractéristiques mécaniques aux températures élevées doivent être transformés à haute température (de 1 000 à 1 500 0C) dans les phases de dégrossissage, les opérations de finition s’effectuant pour les plus résistants soit à froid, soit à tiède (de 400 à 800 0C).Mise en œuvreLes opérations classiques de travail à froid (pliage, emboutissage, repoussage, martelage, etc.) ne présentent pas de difficultés sur le tantale ou le niobium non alliés. Les deux métaux s’usinent bien. On doit cependant tenir compte, si l’on envisage la rectification, d’une forte tendance à adhérer aux outils. Compte tenu de leur très grande réactivité avec l’air dès 100 0C, deux opérations sur eux doivent être conduites avec des soins particuliers:– le soudage, qui doit nécessairement s’effectuer sous argon ou hélium purifié (soudage par point ou à l’arc), ou mieux sous vide (soudage par bombardement électronique); une soudure exécutée dans des conditions correctes possède les mêmes propriétés (plasticité, résistance à la corrosion) que celles du métal de base;– les recuits adoucissants doivent être pratiqués exclusivement sous vide de 10-2 ou de préférence 10-3 à 10-4 pascal, sur des produits dégraissés et décapés.2. PropriétésPropriétés physiquesLe tantale a pour numéro atomique 73 et pour poids atomique 180,95. Ses propriétés physiques marquantes sont portées dans le tableau 2. Le cristal est cubique centré, de paramètre a = 3,296; il n’y a aucune transformation allotropique. Il faut enfin signaler une propriété extrêmement importante: la valeur très élevée (de l’ordre de 25 à 28) de la constante diélectrique de l’oxyde de tantale.Le niobium a pour numéro atomique 41. Son poids atomique est de 92,91. Le tableau 2 rassemble ses principales propriétés physiques. Le cristal est cubique centré à toutes températures (pas de transformation allotropique). La section de capture des neutrons thermiques est faible: 1,1 barn/atome, à comparer, d’une part, avec celle du béryllium (0,009), du magnésium (0,06), du zirconium (0,18), de l’aluminium (0,23) et, d’autre part, du fer et des aciers (2 à 3), du tantale (22).Du point de vue de la résistivité électrique, la température de transition en dessous de laquelle le métal devient supraconducteur (c’est-à-dire prend une résistivité nulle) est de 9,2 K (température la plus élevée des métaux purs), avec, toutefois, un champ critique relativement faible (0,25 T), ce qui est le cas de tous les métaux purs.Enfin, comme l’oxyde de tantale, l’oxyde de niobium a une constante diélectrique élevée (de l’ordre de 20 à 25).Propriétés chimiquesLes deux métaux ont un comportement très voisin avec deux traits dominants: une grande réactivité vis-à-vis des gaz à partir d’une température modestement élevée et une passivité exceptionnelle dans un grand nombre de milieux chimiques agressifs.Réaction avec les gazDans l’air sec ou humide et à température ambiante, les deux métaux restent parfaitement inertes. Dès que la température s’élève, et ce à partir de 200 à 300 0C, on constate une attaque se développant de deux façons: contamination par diffusion de l’oxygène vers l’intérieur; formation d’une couche d’oxyde fragile et à forte augmentation de volume. Cette couche d’oxyde se forme au-dessus du métal et le consomme plus ou moins rapidement. La figure 1 montre, de ce point de vue, les positions relatives du tantale et du niobium par rapport à d’autres métaux.L’hydrogène diffuse et se solubilise dans les deux métaux à partir de 100 0C. La vitesse de réaction croît avec la température, devient notable dès 300 0C et très rapide entre 600 et 800 0C, transformant tout le métal en hydrure extrêmement fragile. L’hydrogène est facilement éliminé par traitement entre 800 et 1 200 0C sous vide. Cette fragilisation par l’hydrogène est un risque grave latent dans la fabrication et l’utilisation. Tout particulièrement pour les emplois en milieux corrosifs, on évitera très soigneusement de provoquer une formation d’hydrogène naissant au voisinage du tantale et du niobium et, par exemple, les contacts avec le graphite ou des métaux tels que le fer, l’aluminium, le zinc par rapport auxquels le tantale ou le niobium sont cathodiques.La plupart des autres gaz (ammoniac, gaz de combustion, CO, CO2) réagissent avec les deux métaux à plus ou moins haute température.Jusqu’à 200 0C, l’eau et la vapeur d’eau n’ont aucune action, ni corrosive ni fragilisante, à condition bien sûr que tout autre gaz soit éliminé et aussi que le pH soit maintenu inférieur à 8. Au-delà de 200 0C, on constate une détérioration progressive de la tenue par suite d’une fragilisation par l’hydrogène.Réaction avec les milieux chimiquesEn résumé, on peut dire que le tantale résiste parfaitement, jusqu’à des températures de 180 à 200 0C, à tous les milieux acides ou neutres, aussi complexes qu’on puisse les imaginer, avec les exceptions suivantes: présence d’acide fluorhydrique, ou de fluor ou d’ions - libres; présence de S3 libre.En revanche, les bases fortes, même à faible concentration, attaquent et fragilisent le tantale à chaud.Vis-à-vis de nombreux acides, le tantale présente donc une inertie très voisine de celle du verre (sans en avoir la fragilité) et résiste même beaucoup mieux que lui aux solutions chaudes d’acide chlorhydrique.La figure 2 donne les tenues comparées du tantale et de quelques autres métaux dans l’acide chlorhydrique chaud et dans l’acide sulfurique bouillant. Cette immunité remarquable du tantale est due à la présence d’une couche superficielle d’oxyde Ta25 extrêmement tenace.On constate de très grandes similitudes du niobium avec le tantale, en particulier pour l’essentiel des phénomènes qui expliquent la remarquable résistance à la corrosion; mais la tenue de la couche passivée est moins bonne et la sensibilité à l’hydrogène plus grande.À 100 0C, la liste des milieux vis-à-vis desquels le niobium reste absolument inerte est relativement limitée: acide nitrique à toute concentration, acide chlorhydrique dilué, acide sulfurique à 20 p. 100, acide tartrique.En résumé, le niobium est un métal extrêmement résistant à la corrosion si on le compare au titane, aux aciers inoxydables, etc.; mais dans l’ensemble des cas cette résistance est presque toujours inférieure et au mieux égale à celle du tantale.Réaction avec les métaux fondusLa tenue du niobium et du tantale est généralement bonne en comparaison de celle d’autres métaux. Il n’y a pratiquement aucune attaque par le bismuth (jusqu’à 560 0C), le gallium (jusqu’à 400 0C), le plomb (jusqu’à 850 0C), le lithium (jusqu’à 1 000 0C), le mercure (jusqu’à 600 0C), le sodium, le potassium et leurs mélanges (jusqu’à 1 000 0C), l’étain (jusqu’à 700 0C), le zinc (jusqu’à 450 0C).Propriétés mécaniquesTant pour le tantale que pour le niobium, les propriétés mécaniques sont très sensibles à la pureté du métal et tout particulièrement aux teneurs en éléments interstitiels (oxygène, azote, carbone, hydrogène) qui provoquent un durcissement et une fragilisation. Pour un métal utilisable industriellement, il est souhaitable que le niveau de toutes ces impuretés reste inférieur à 100 ppm. C’est le cas du tantale et du niobium dits de pureté commerciale.Dans ces conditions de pureté et à l’état recuit, les deux métaux se caractérisent, à température ordinaire, par une dureté Vickers de 60 à 80 et une résistance à la rupture en traction de 30 à 45 hbar, avec les allongements correspondants de 25 à 40 p. 100.Comme pour tous les métaux, on observe une chute brutale de la ductilité en deçà d’une certaine température, dite température de transition ductile-fragile; elle est de l’ordre de 漣 150 0C pour le niobium et de 漣 270 0C pour le tantale (alors qu’elle est très nettement supérieure à 20 0C dans le cas de métaux tels que le tungstène ou le molybdène).3. Alliages à base de tantale ou de niobiumLes alliages élaborés à base de tantale ou de niobium ont pour but d’améliorer les propriétés de ces métaux principalement dans trois domaines: la supraconductibilité (niobium seulement); la tenue à la corrosion chimique; la tenue mécanique aux hautes températures (et corrélativement la résistance à l’oxydation).Les alliages supraconducteursUn matériau devient supraconducteur (c’est-à-dire possède une résistivité électrique nulle) lorsqu’il est maintenu à une température inférieure à une certaine valeur Tc (dite température critique), soumis à un champ magnétique inférieur à une certaine valeur Hc (dite champ critique) et parcouru par un courant d’une intensité inférieure à une certaine valeur (dite intensité critique Ic ). Chacune de ces valeurs critiques est en outre fonction des deux autres. Le but des alliages est d’obtenir des Tc , Hc , Ic de plus en plus élevées et des relations f – par exemple Hc = f (Ic ) – les plus favorables possibles. Le tableau 3 présente les valeurs de Tc et Hc (à 4,2 K) obtenues pour le niobium et certains de ses alliages.Les valeurs de Tc , Ic , Hc et les relations qui les lient dépendent non seulement de la composition de l’alliage, mais aussi, et très fortement, de sa teneur en impuretés, de son état structural (l’écrouissage et autres défauts de structure favorisant la supraconductivité), de son traitement thermique.Historiquement, ce sont les alliages Nb-Zr qui furent les premiers fabriqués industriellement, mais ils ont été totalement supplantés par les Nb-Ti, qui non seulement ont de meilleures propriétés globales, mais sont aussi beaucoup plus ductiles (même très ductiles). Les propriétés du Nb3Sn sont jusqu’ici inégalées; malheureusement, il s’agit là d’un composé intermétallique extrêmement fragile dont la mise en forme en tant que tel est quasi impossible. Pour le mettre en œuvre, il faut donc recourir à des procédés très spéciaux, ce qui freine son développement.Les alliages résistant à la corrosion chimiqueDans le cas du tantale, les additions se sont en général révélées néfastes pour la tenue à la corrosion. Seules les additions du tungstène (de 10 à 30 p. 100) améliorent légèrement son comportement, surtout en milieux fluorés. L’addition de titane (de 5 à 20 p. 100) augmente la tenue dans l’acide nitrique concentré à chaud.En pratique, on en reste donc au tantale non allié, avec toutefois une tendance croissante à l’emploi de tantale contenant entre 1 et 3 p. 100 de tungstène qui est semblable au tantale non allié du point de vue résistance à la corrosion, mais qui présente une meilleure résistance mécanique sans perte trop grave de ductilité.Dans le cas du niobium, on a mis au point, pour résister à la vapeur d’eau, des alliages avec additions de Ti, V, Cr. Dans les métaux fondus, l’alliage Nb + 1 p. 100 Zr résiste plutôt mieux que le niobium non allié. Certaines additions (tantale, vanadium, cuivre) améliorent la tenue du niobium dans les milieux très agressifs.Alliages réfractaires pour hautes températuresPartant des propriétés mécaniques favorables du niobum à haute température, on peut considérer que ce métal est une base intéressante puisqu’il a une faible densité (par rapport aux autres métaux réfractaires, tungstène, tantale, molybdène), une résistance à l’oxydation moins mauvaise que celle du molybdène et une ductilité à froid supérieure.Pour améliorer la tenue à chaud, on durcit la matrice niobium soit en introduisant des durcisseurs rentrant en solution solide (le tungstène et le molybdène sont, de ce point de vue, les éléments les plus efficaces), soit en utilisant des dispersions stables: la présence dans la matrice de zirconium ou d’hafnium d’une part, de carbone, d’oxygène, d’azote ou de bore d’autre part conduit à la formation de composés. La taille et la dispersion de ces phases hors solution peuvent être contrôlées par des traitements thermiques convenables. Ces dispersions bloquent efficacement le mouvement des dislocations et, par conséquent, gênent la déformation de fluage à chaud.L’une des difficultés vient de l’effet plus ou moins marqué de toutes ces additions sur la ductilité.D’autre part, puisqu’il s’agit d’alliages devant résister à chaud, on a cherché à améliorer la résistance à l’oxydation, relativement mauvaise, du niobium. Malheureusement, les additions qui ont quelque effet de ce point de vue (Ti, Al, Si, Cr) ont soit une influence néfaste sur la tenue au fluage, soit fragilisent le plus souvent l’alliage de façon inacceptable.Comme il n’a pas été possible jusqu’à présent de concilier les deux nécessités, on s’est axé uniquement sur l’aspect résistance mécanique en laissant le soin à des revêtements protecteurs de pallier le manque de résistance à l’oxydation. Mais le problème du revêtement protecteur correct est encore très imparfaitement résolu.La figure 3 situe les alliages de niobium par rapport à d’autres alliages résistants à chaud (sur la base de la résistance spécifique, car les applications majeures de ces alliages se situent dans les industries aérospatiales).Dans le cas du tantale, les recherches d’alliages résistants à chaud ont été moins poussées. A priori, la très haute température de fusion du tantale permet de penser que les alliages à base de tantale seront beaucoup plus réfractaires que ceux du niobium. Mais la densité du tantale constitue un lourd handicap dans les applications aérospatiales, qui sont les seules tentantes pour l’instant. Avec des additions de tungstène, de hafnium, de vanadium, les caractéristiques qu’on obtient entre 1 200 et 1 500 0C sont intéressantes.4. ApplicationsÉnergie nucléaireLe niobium et certains de ses alliages (par exemple Nb + 1 p. 100 Zr) peuvent être utilisés comme des matériaux de gainage et comme conduites de fluides caloporteurs des réacteurs nucléaires avancés fonctionnant à haute température. Les avantages du niobium sont ici la faible section de capture, la compatibilité avec la plupart des combustibles et fluides caloporteurs et la résistance mécanique à chaud intéressante.Génie chimiqueLes applications du tantale sont ici très nombreuses. C’est principalement dans les milieux acides chauds, et tout particulièrement en milieu sulfurique, qu’il est employé, soit sous forme de revêtement chaudronné placé dans des capacités en acier, soit sous forme de tubes constituant des échangeurs de chaleur. Le tantale apparaît comme un métal tout à fait indispensable dans le génie chimique moderne. Citons encore les implants dentaires, les fils et plaques utilisés en chirurgie, le tantale restant inerte dans le corps humain.ÉlectroniqueL’application aujourd’hui la plus importante du tantale, si l’on considère les quantités consommées, se rencontre dans la fabrication des condensateurs soit sous forme de feuille mince, soit surtout sous forme d’anode frittée. Les condensateurs qu’on réalise ont une très forte capacité et des caractéristiques très stables dans un large domaine de température (de 漣 70 à + 200 0C).Le condensateur à feuille de tantale a, pour un même volume, une capacité sept fois plus forte que le condensateur papier. Les performances des condensateurs à anode poreuse, schématisés sur la figure 4, sont encore plus remarquables.La pièce principale est l’anode, obtenue par frittage de poudre de tantale à température relativement basse (de 1 800 à 2 000 0C), ce qui laisse une grande porosité ouverte (de 30 à 50 p. 100). L’anode est ensuite oxydée anodiquement. La porosité de l’anode donne une surface active très élevée, et la capacité par unité de volume est mille fois supérieure à celle du condensateur papier. L’utilisation de tels condensateurs en électronique permet de miniaturiser davantage les circuits; elle se répand dans tous les domaines, y compris celui de la consommation courante.SupraconductivitéCe domaine est dominé par le niobium et ses alliages, alors que le tantale en est quasiment exclu.L’utilisation du niobium ou de ses alliages dans leur état supraconducteur ouvre des horizons immenses à toute l’électrotechnique (générateurs, moteurs, bobinages magnétiques, lignes de transport), car on pourrait ainsi produire, absorber ou transporter des puissances énormes sous de très faibles volumes et pratiquement sans perte. Toutefois, de très gros problèmes restent encore à surmonter. C’est pourquoi il n’y a pour l’instant que quelques très rares réalisations de laboratoire dans le domaine du moteur, du générateur ou du conducteur de puissance.En revanche, un développement important se rencontre dans un domaine relativement plus facile, celui des bobines électromagnétiques dont a besoin la physique avancée pour disposer de champs magnétiques extrêmement intenses, irréalisables par d’autres moyens. Les conducteurs utilisés sont du type de ceux dont une section est reproduite sur la figure 5.Utilisations à haute températureLa réalisation de résistors et d’écrans de fours à vide à très haute température constitue une application relativement banale du tantale. Par rapport à ses concurrents (molybdène et tungstène) dans ce domaine, le tantale présente l’avantage d’une mise en forme très facile et de ne pas se fragiliser trop rapidement en service.Pour les alliages de niobium, deux types d’applications beaucoup plus avancées sont étudiés:– dans les moteurs à réaction, d’une part, où le remplacement des alliages superréfractaires par des alliages de niobium dans la partie turbine permettrait de fonctionner à une température plus élevée de 150 0C, donc d’obtenir un gain de puissance substantiel; mais les alliages de niobium en question n’ont pas une bonne résistance à l’oxydation, et il faut les munir de revêtements protecteurs; les progrès dans ce dernier domaine n’ont pas été aussi rapides que dans celui de la métallurgie, et si les meilleurs revêtements connus protègent très efficacement à l’origine, ils se dégradent toutefois assez rapidement et ont donc une durée de vie limitée et encore insuffisante;– dans les véhicules spatiaux d’autre part, pour réaliser les parties de structure qui subissent des échauffements très élevés au moment de la rentrée dans l’atmosphère terrestre.Le tantale est utilisé en tant qu’addition (en teneur de 4 à 10 p. 100) dans des alliages superréfractaires à base de nickel ou de cobalt.Enfin, on ajoute du carbure de tantale au carbure de tungstène pour réaliser des carbures frittés pour outils de coupe de haute performance.Le niobium s’avère être un élément d’addition de plus en plus largement utilisé en aciérie, pratiquement dans toutes les qualités d’aciers ou de superalliages. Il a pour effet, suivant les types d’aciers, de permettre une répartition fine et stable des carbures, ou d’affiner et de stabiliser le grain, ou de réduire notablement les phénomènes de corrosion intergranulaire. Le niobium n’est pas introduit dans ce cas sous forme métallique mais sous forme d’alliages mères, ferro-niobium ou ferro-niobium-tantale, obtenus directement par aluminothermie à partir des minerais riches concentrés.Production et consommationLa production totale de tantale métallique dans le monde capitaliste a été de 750 t en 1970 et de 1 000 t environ en 1982. La consommation de ce métal en 1970 s’est répartie comme suit: 65 p. 100 pour la fabrication de condensateurs (il faut à ce sujet noter que si, dans les dix dernières années, la production annuelle de condensateurs au tantale a été multipliée par un facteur proche de 1 000, la consommation correspondante a cependant beaucoup moins progressée du fait des améliorations considérables obtenues dans les propriétés ad hoc des poudres de tantale), 20 p. 100 pour la production de demi-produits destinés aux appareillages de génie chimique, 10 p. 100 pour la production de carbure de tantale et 5 p. 100 pour addition dans les alliages super-réfractaires. Plus de 75 p. 100 du tantale produit est consommé aux États-Unis.En niobium contenu, la production totale du monde capitaliste a été de 7 000 t en 1970 et de 10 000 t par an à partir de 1978 jusqu’en 1982. Mais la quasi-totalité a été utilisée en tant que ferro-niobium, donc sans passer par le stade de l’extraction du niobium métallique. Dans cette production, les États-Unis interviennent pour 20 p. 100, la république fédérale d’Allemagne pour 16 p. 100, la France, la Grande-Bretagne, le Canada, le Japon pour 12 p. 100 chacun, l’Autriche et la Suède pour 7 p. 100 chacune. Entre 1982 et 1990, il n’y a guère eu de modifications.La production de niobium métallique oscille entre 15 et 60 t par an, dont 90 p. 100 aus États-Unis, qui interviennent également pour 90 p. 100 dans la consommation mondiale, pour les applications suivantes: alliages supraconducteurs, 70 p. 100; alliages résistants à chaud, 15 p. 100; énergie nucléaire, 10 p. 100; divers, 5 p. 100.
Encyclopédie Universelle. 2012.
